一、引言
重组蛋白通过重组DNA技术生产,广泛应用于工业、农业及环境领域。其表达系统主要包括原核细胞、酵母细胞、昆虫细胞和哺乳动物细胞。其中,大肠杆菌系统具备周期短、成本低的优势,但常因目标蛋白形成包涵体而导致溶解度低、纯化困难,且缺乏翻译后修饰(Post-translational modifications, PTM),致使生物活性受限。酵母与昆虫细胞系统虽可实现较高产量,但其PTM模式与哺乳动物细胞存在差异。而哺乳动物表达系统能产生类人源PTM,尤其适用于大分子复合物的表达,但产量普遍较低。近年来,尽管重组DNA技术持续发展,部分蛋白质仍因结构复杂性或特殊性质面临“难以表达”问题,表现为表达量低、纯化困难、稳定性差或溶解度不足。为应对这些挑战,在重组蛋白的N端或C端融合标签已成为关键,这一策略既可维持天然蛋白结构,又能显著提升表达效率。本文将系统阐述近年来重组蛋白生产中融合标签的研究进展。
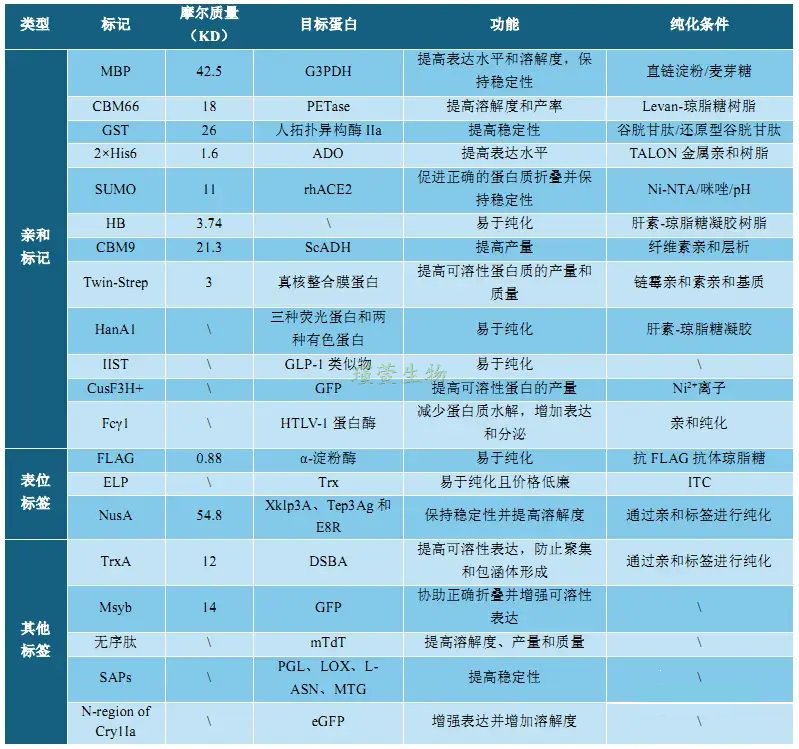
如表1所示,重组蛋白生产中的融合标签主要分为三类:亲和标签、表位标签以及荧光标签等其他标签。其中,亲和标签由几个至数百个氨基酸肽段组成,融合于重组蛋白的N端或C端,可显著增强蛋白溶解度、稳定性及表达水平,并直接用于亲和层析纯化(图1)。表位标签有诸如血凝素(Hemagglutinin, HA)、FLAG、等小分子肽,适用于蛋白质相互作用、Western blot等免疫学检测,也可通过特异性抗体或亲和层析纯化。荧光标签如绿色荧光蛋白、黄色荧光蛋白、青色荧光蛋白和红色荧光蛋白,则用于活/死细胞实时成像与动态追踪[1]。
二、融合标签的功能
2.1便于纯化
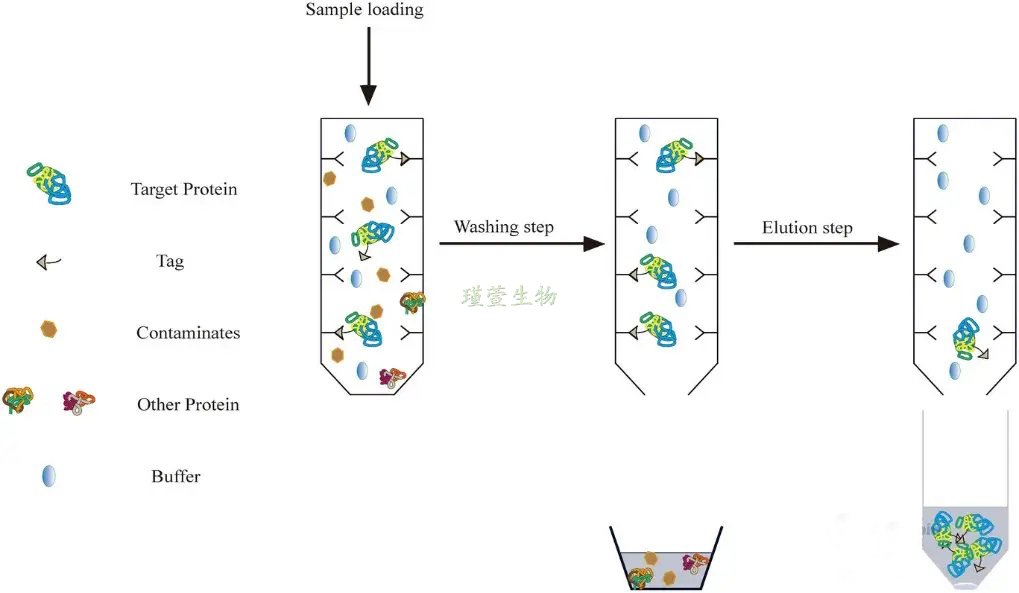
在重组蛋白纯化中,His标签因其分子量小、可灵活融合于蛋白N/C端而成为首选。该标签通过螯合过渡金属离子Ni²⁺、Co²⁺等实现亲和层析,并兼容变性与非变性条件,便于设计包含蛋白质重折叠的纯化方案(图2)。FLAG标签也广泛应用于蛋白纯化,其三重变体(3×FLAG)可有效纯化低丰度、难表达蛋白;该标签通过抗FLAG抗体结合,经游离3×FLAG肽竞争性洗脱,且下游易切除。麦芽糖结合蛋白(Maltose-binding protein, MBP)标签通过结合直链淀粉树脂实现一步纯化,洗脱时需含10 mM麦芽糖的缓冲液。此外,肝素结合(Heparin binding, HB)标签利用成纤维细胞生长因子等蛋白与肝素的天然高亲和力,通过肝素琼脂糖层析一步纯化,且结合活性不受高浓度变性剂影响[2]。
2.2 提高溶解度
许多重组蛋白在大肠杆菌中易形成不溶性包涵体,提高溶解度是其表达关键。MBP是高效的增溶剂,可提升重组蛋白表达水平和溶解度,N端融合效果优于C端。其最小表位标签的核心序列“EKDT”已被鉴定,但能否促进正确折叠尚待研究。氮利用物质A参与转录,能延长蛋白质折叠时间,作为标签可增强重组蛋白稳定性和溶解度,但需额外融合亲和标签(如6×His)进行纯化。硫氧还蛋白A(Thioredoxin A, TrxA)过表达可显著提升重组蛋白可溶性表达,具有伴侣样特性,减少聚集和包涵体形成,N端融合更优,同样需要亲和标签辅助纯化。
2.3 提高稳定性
谷胱甘肽S-转移酶(Glutathione S-transferase, GST)标签与重组蛋白融合时,不仅提供亲和纯化位点,还能通过其亲水性结构域的空间位阻效应抑制蛋白酶降解、稳定蛋白构象。小泛素相关修饰蛋白(Small ubiquitin-like modifier, SUMO)标签因其热稳定性与蛋白酶抗性,可有效维持重组蛋白的稳定性,并广泛适用于真核/原核表达系统。其核心优势在于SUMO蛋白酶的高特异性识别能力,该酶可精准切割SUMO标签C端而不残留额外氨基酸,且在4~37°C的宽泛温度、5.5~10.5 pH范围及化学环境下保持高效活性。同样,MBP标签通过疏水作用屏蔽融合蛋白的水解敏感区域,进一步增强重组蛋白稳定性[3]。
2.4 其他
此外,融合蛋白在提高蛋白产量、分子伴侣、成像方面都具备一定的功能。例如,有实验发现通过融合His标签,酰基载体蛋白还原酶的表达量可达未融合版本的7.2倍。除了在大肠杆菌系统中有效提高重组蛋白的溶解度和稳定性外,MBP标签还被证明能增加重组蛋白在哺乳动物表达系统中的产量。SUMO融合标签不仅用于促进蛋白质表达,还能协助其正确折叠,发挥分子伴侣的功能。另有研究利用具有高聚集倾向的重组蛋白测试了三种高酸性大肠杆菌衍生肽,发现这些高酸性蛋白作为融合标签时,在促进可溶性和正确折叠方面的表现优于其他常用标签,展现出分子伴侣特性。
三、较新颖的融合标签
3.1CBM标签
碳水化合物结合模块(Carbohydrate-binding module, CBM)种类繁多,基于氨基酸序列、结合特异性和结构已分类为88个不同的家族,其中许多已被用作亲和标签以提高重组蛋白产量。常用且能结合纤维素的CBM标签包括CBM3和CBM9。例如,CBM9作为N端融合标签成功与酿酒酵母醇脱氢酶1融合,通过一步固定化/纯化过程,利用低成本、高选择性的纤维素载体实现了对目标重组蛋白的结合,该策略作为金属亲和层析的替代方案,不仅将蛋白纯度提高了5倍,还几乎完全保留了其活性。目前,研究人员开发了一种基于CBM66的新型融合标签,用于在大肠杆菌中高效表达可溶性异源蛋白。该策略将CBM66融合至目标重组蛋白的N端,并在C端添加His标签以便于纯化和鉴定。标签与重组蛋白之间通过包含四个甘氨酸和一个丝氨酸的双重复序列连接子连接,并插入肠激酶识别位点以实现融合蛋白的选择性切割。与未融合蛋白相比,CBM66融合蛋白显著提升了重组蛋白的溶解度和产量。
3.2链球菌标签
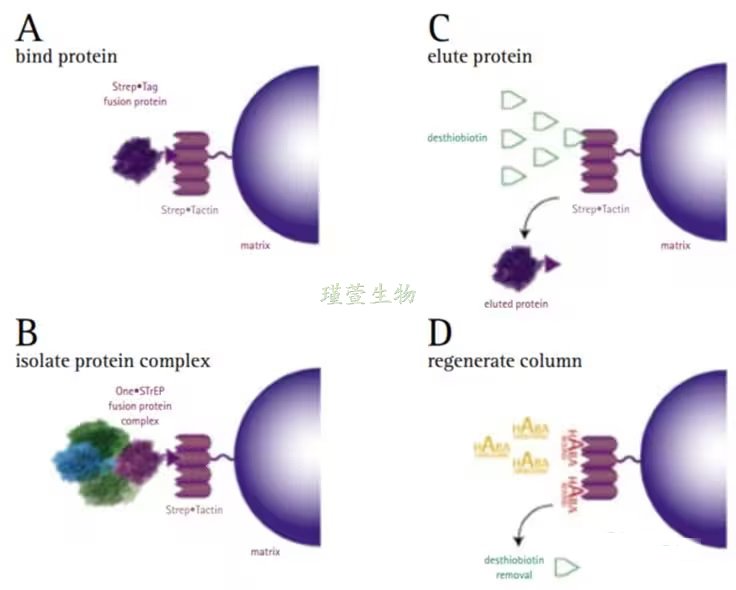
Twin-Strep标签由两个Strep标签II经接头串联而成,专为大规模蛋白纯化设计。其兼具Strep标签II的优势,如温和条件下的高效洗脱。Twin-Strep/Strep-Tactin系统结合力强,耐受变性剂,能在苛刻条件下牢固结合蛋白。纯化真核膜蛋白时,其效果优于His标签,显著提升产量和质量。通过诱变获得的Strep-Tactin XT变体比Twin-Strep标签亲和力更强,可实现动力学稳定固定。Strep TagII则是另一种链球菌标签,其为小型惰性亲和肽具有细胞蛋白酶抗性,兼容温和去污剂。它在重组蛋白的N端或C端融合均有效,生理条件下纯化效果优异,且不干扰蛋白折叠或活性,是理想的亲和标签[4]。
3.3 ELP标签与α标签
弹性蛋白样多肽(Elastin-like polypeptide, ELP)标签含Val-Pro-Gly-Xaa-Gly重复序列专为无需层析的蛋白纯化设计。融合蛋白可在温和升温或高盐条件下发生可逆沉淀,利用相变温度(Transition temperature, Tt)差异通过选择性沉淀/离心进行纯化。研究表明,其Tt可通过盐或PEG浓度调节,适应4-37.5°C范围。此外,改良型富含组氨酸或多功能ELP标签还能实现pH依赖纯化及特异性检测。另有,Gotzke团队开发了一种一个表位ALFA标签和一个由两种特殊纳米材料构成的ALFA系统。该标签具有亲水性、生理pH中性电荷及稳定α-螺旋结构,可融合于重组蛋白任意端或结构域间。
3.4 无序肽标签与自组装两亲性肽
也有研究表明,融合小分子无序肽标签可显著提升重组蛋白的溶解度,且不影响其活性或增加宿主细胞负担。例如,53个氨基酸的NEXT标签能有效增溶易聚集蛋白。此外,新型小分子量、高溶解性合成内在无序蛋白SynIDP通过从头设计,可使多种难溶重组蛋白实现可溶性表达,且无需移除标签即可保持融合蛋白活性,突显了其作为高效溶解度标签的应用前景。
3.5 人膜联蛋白A1与Fcγ1标签
Annexins是一类进化保守的多基因蛋白家族,广泛分布于真核生物中。He等人以人膜联蛋白A1作为N端标签,将其与EmGFP、mCherry、黄素结合青绿色荧光蛋白LOV、玻璃体血红蛋白、玉米盐酸铁螯合酶五种蛋白融合表达于大肠杆菌。实验表明,经单步纯化后所有融合蛋白回收率均超70%。值得注意的是,HanA1-EmGFP能与肝素琼脂糖凝胶强力结合,其通过金属离子亲和层析的纯化效率与His6标签标记的HanA1-EmGFP相当。Fcγ1是IgG1抗体重链的恒定区。Fcγ1融合标签能有效促进重组蛋白的检测与纯化,减少蛋白酶解,并增强其表达与分泌。通常将重组蛋白的C端直接或通过接头融合至Fcγ1片段的N端。如有需要,可利用间隔接头中的切割位点去除Fc标签。例如,在重组HTLV-1蛋白酶(HTLV-1-PR)研究中,采用Fcγ1标签构建了融合蛋白HTLV-1-PR-Fcγ1。免疫荧光共定位分析证实,与抗Fcγ抗体结合的融合蛋白折叠正确;Fcγ1标签还介导了HTLV-1-PR-Fcγ1形成二聚体分泌蛋白。此外,Fcγ1标签能显著延长用于体内及治疗研究的蛋白质的血清半衰期。
3.6 自切割标签与CusF
自裂解标签无需额外蛋白酶切即可实现大肠杆菌重组蛋白的一步亲和纯化。商品化的内含肽介导系统存在非受控切割问题,会降低产量。为此,研究者开发了条件诱导型IIST系统和周质表达专用系统。后者结合N端信号肽与C端pH/温度诱导型内含肽标签,能在特定条件下实现含二硫键RP的高效周质表达与单步纯化。金属结合蛋白CusF3H+是一种新型高效融合标签,通过在大肠杆菌N端添加三个组氨酸残基强化其功能,显著提升重组蛋白的可溶性表达并降低包涵体形成。该标签可通过固定化金属离子亲和层析结合Cu²⁺/Ni²⁺树脂实现一步纯化,其标记的GFP融合蛋白经纯化后纯度显著提升。CusF3H+分子量仅10kDa的特性使标签切除后能获得高产量目标蛋白,且相较于传统His标签,其能进一步增强重组蛋白溶解度[5]。
结语
融合标签技术在重组蛋白生产中展现出提升溶解度、简化纯化及增强稳定性的核心价值,但其功能单一性与系统普适性仍是关键瓶颈。当前策略聚焦协同增效与创新设计,如串联亲和纯化系统SUMO-TrxA双标签提高蛋白的可溶性表达率;多技术联用有效抑制重组人ACE2等蛋白的包涵体形成;而基于无序肽、CBM、Fcγ1等机理的新型标签在靶向增溶与一步纯化方面都取得了突破。未来该领域的发展方向有,一是开发跨原核/真核系统的通用型多功能标签,克服现有标签的体系局限性;其次,构建模块化平台实现结构域智能组合,适配不同蛋白特性;最后,需要融合计算设计与高通量筛选优化标签-蛋白协同效应,最终推动重组蛋白的标准化、规模化生产。
Copyright © 2022-2030 武汉瑾萱生物科技有限公司 版权所有 地址:武汉东湖新技术开发区光谷三路777号自贸生物创新港B区(生物医药平台检验研发楼) 备案号:鄂ICP备2022008796号 网站地图