1 膜蛋白
膜蛋白约占生物体内细胞蛋白的三分之一,是超过一半药物中的重要靶标。膜蛋白参与重要的生物过程,例如细胞信号传导、分子运输、光合作用、生物能量过程和催化。从结构上讲,它们可以大致分为四个主要类别:外周型、两亲型、脂锚定型和整合型。
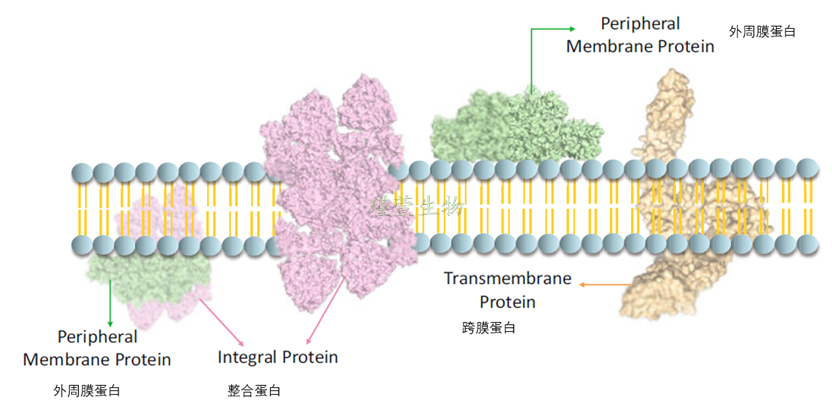
图1 膜蛋白的类型
1.1 遇到的问题
许多因素导致膜蛋白的表达、纯化、结晶和结构解析困难,例如相对疏水的表面、柔韧性、低表达水平和不稳定性。此外,由于膜蛋白的丰度较低,从其天然来源中纯化就具有挑战性。其他异源表达系统中的膜蛋白过表达通常会导致低表达量或非功能性蛋白质的产生,其可能的原因除了过表达的细胞毒性外,也可能是由于不充分的蛋白插入膜结构难以稳定构象及蛋白的错误折叠。因此,选择合适的表达系统是此过程中的关键步骤。
1.2 纯化策略
1)成功的纯化策略包括选择合适的宿主菌株、载体、启动子、选择标记、最佳基因序列以及适当表达和纯化此类蛋白质。
2)如果膜蛋白是在天然来源中产生,则采用不需要标签的高度特异性初始纯化方法。通过离子交换色谱通常与其他经典色谱方法结合使用,最后凝胶过滤即可。对于异源宿主的重组膜蛋白则可以在原核或真核细胞的多种宿主中表达。
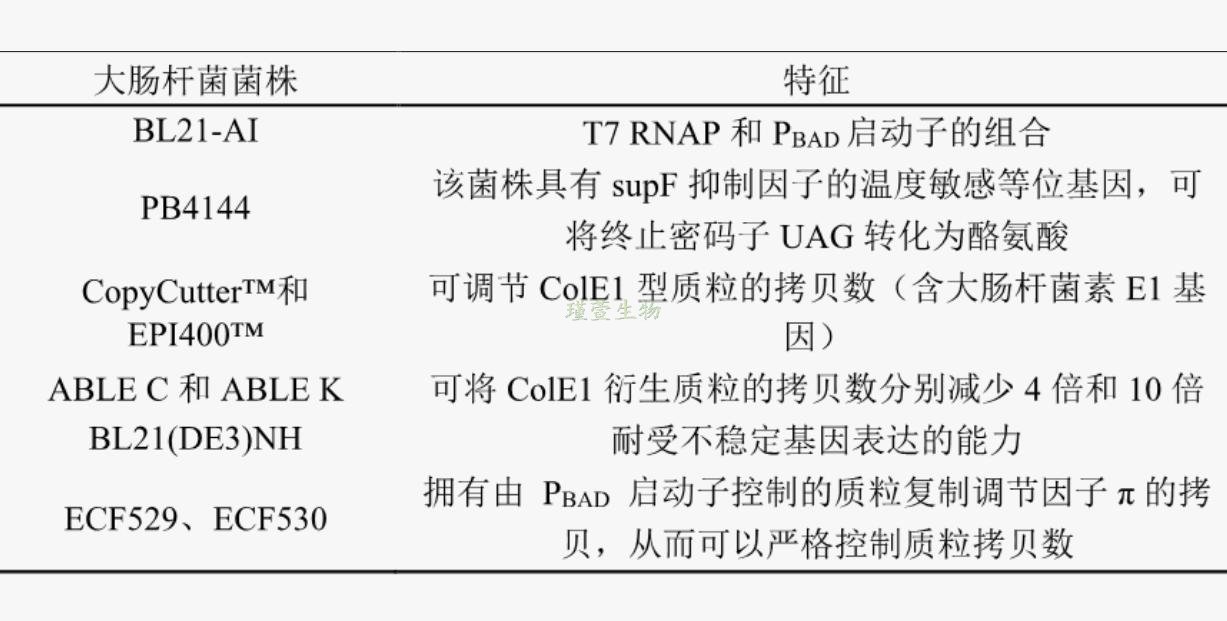
3)最大化膜蛋白表达需要选择最合适的关键元件组合,例如载体和表达宿主。传统的克隆方法已经发展到可以同时将基因快速克隆到多个表达载体中来进行平行表达筛选。然而,这些方法无法预测目的蛋白是否会充分表达,是否易于纯化或表征。因此,一旦将目的基因克隆到表达载体中,可能需要测试不同的表达系统以确认是否产生膜蛋白。所以选择合适的表达系统是此过程中的关键步骤。每个表达系统都有各自的特点,如表所示,可根据需求选择合适的表达系统。
表1 表达系统的简要总结

除了表达系统的选择,表达载体的设计与构建也是膜蛋白生产中最重要的步骤之一,该构建载体应有助于蛋白质的最佳转录、翻译和定位至膜,然后易于检测和分离。需要注意的是,设计不应改变蛋白质的结构功能。构建载体包括序列、标签、切割位点,启动子与质粒,抗生素与药物筛选,培养生长条件,表面活性剂和缓冲系统等方面。
2 毒性蛋白
在生长阶段导致宿主细胞蛋白表达死亡或培养和维持阶段出现问题的蛋白质被称为毒性蛋白。大肠杆菌系统提供了一种大规模生产重要及商业化蛋白的最经济方式,但细胞毒性是这一过程的主要障碍。大约80%表达的重组蛋白对其宿主都有一定程度的毒性,其中大约10%会造成严重损害。
表2 用于生产毒性蛋白的大肠杆菌菌株
2.1 遇到的问题
蛋白质毒性以多种方式表现,与常规转化实验相比,获得很少或没有菌落很可能是毒性的现象。
编码毒性蛋白的载体的转化效率明显低于对照载体或无毒蛋白质的载体。在大肠杆菌中,诸如lac启动子的泄漏允许在没有诱导剂的情况下表达某些蛋白质。这可能导致质粒不稳定和/或质粒丢失,这是氨苄青霉素标记的常见问题。
2.2 纯化策略
蛋白质毒性问题的解决方案包括多管齐下的策略,如图所示,该图的左侧部分显示了如何通过使用低拷贝质粒、降低启动子使用频率或降低温度等多种方式降低渗漏或整体表达直到诱导表达阶段,右侧部分则显示了如何通过将毒性蛋白沉淀在包涵体中或将它们直接分泌到细胞外来防止细胞生长的减少或死亡。
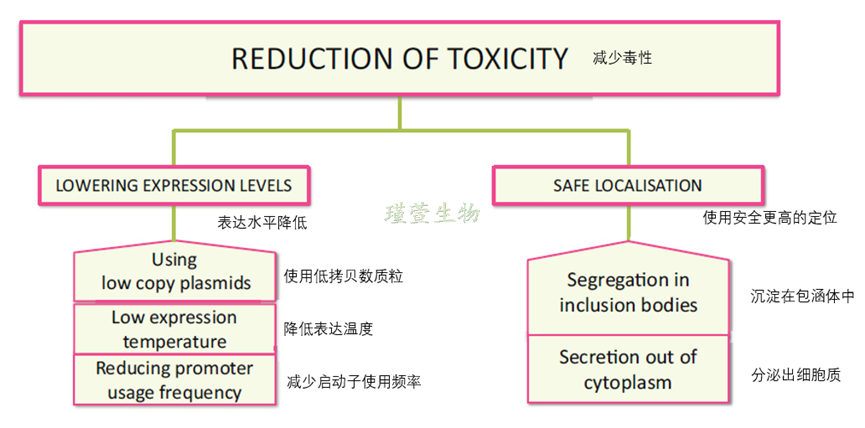
图2 降低蛋白质毒性
毒性蛋白可以通过多种方式进行调节,包括使用具有严格调控的启动子的T7 RNAP、使用低拷贝数质粒、从pLysS/ pLysE质粒中组成表达噬菌体T7溶菌酶,在诱导型启动子上游使用强终止子,以及优化培养条件(诱导时间、浓度和温度)等。
3 包涵体
在大肠杆菌中表达大量重组蛋白(>总细胞蛋白的2%)有时会导致形成称为“包涵体”的聚集体。包涵体通常聚集在细胞质中,如果在编码蛋白质的载体中使用信号肽序列,则会分泌在周质空间中。
诱导包涵体形成的培养条件包括高温、高浓度诱导剂、强启动子、目的基因的高拷贝数、高疏水性、缺乏真核伴侣蛋白以及细菌细胞质的还原环境等。目的蛋白的包涵体具有产量高和纯度高等优点,这些蛋白质在包涵体中可以受到保护,远离蛋白水解酶的作用,并且提供了一种在不杀死细胞的情况下产生毒性蛋白的方法。
3.1 遇到的问题
包涵体是从宿主中纯化重组蛋白的主要障碍。纯化包括分离、溶解和重折叠以产生功能性蛋白质。尽管技术不断进步,但提取和获得重折叠最终活性蛋白的产量仍然非常低。
3.2 纯化策略
当面临包涵体问题时,可以通过优化条件以使目的蛋白可溶或从沉淀中纯化蛋白并重新折叠,例如降低温度、诱导时间、诱导剂浓度、细胞密度以及增加促溶解的标签、伴侣蛋白的共表达和使用适当的表达宿主等。纯化的基本步骤,包括溶解、提取和重折叠以产生功能性蛋白质,如图所示:(a)细胞通过机械或化学方法破碎,包涵体通过离心分离。(b)随后洗涤以去除不需要的化学物质,(c)使用表面活性剂溶解,和(d)复性或重新折叠以产生折叠良好的功能性蛋白质。复性过程通常涉及透析和/或凝胶过滤。(e)最终使用合适的技术如层析法纯化复性蛋白。
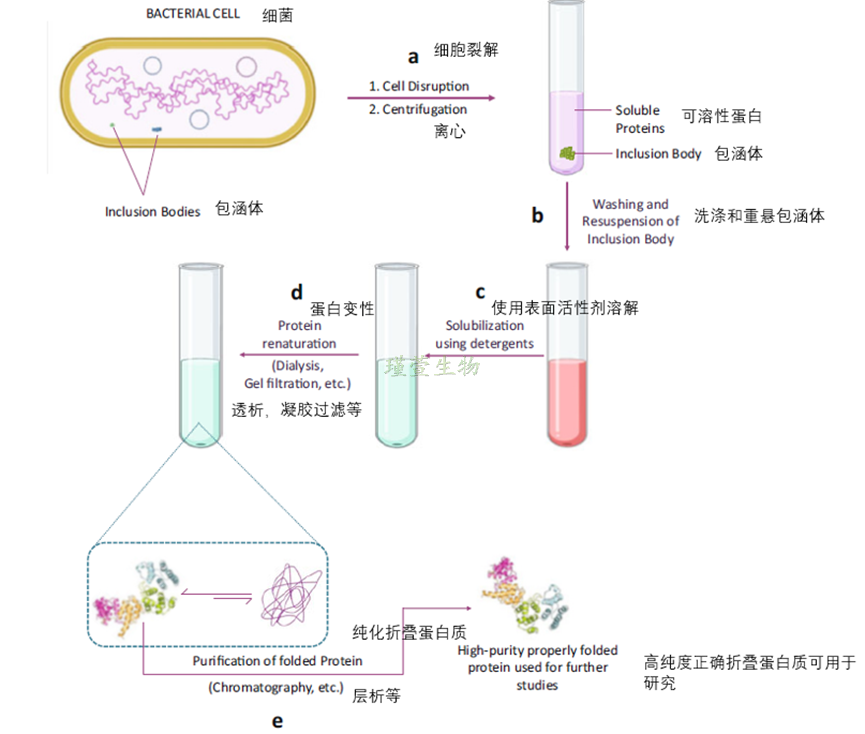
图3 包涵体中纯化蛋白质步骤
4 结论
随着时间的推移,重组蛋白生产技术取得了巨大的进步,但研究者在克服表达和纯化“困难”蛋白质方面仍然面临巨大挑战。本文讨论了最突出的具有挑战性的蛋白质类别,旨在总结遇到的常见问题以及可以用来解决这些问题的一般方法。虽然本文讨论的三类蛋白质在性质上有所不同,但用于优化生产这些蛋白质的技术经常互相重叠。
总体而言,处理这些蛋白质的常规方法包括适当的构建载体设计、优化表达和培养条件以及使用有效的方法和合适的试剂纯化蛋白。但由于每种蛋白质都是独特的,这些通用策略需要针对每个蛋白进行修改和定制。
Copyright © 2022-2030 武汉瑾萱生物科技有限公司 版权所有 地址:武汉东湖新技术开发区光谷三路777号自贸生物创新港B区(生物医药平台检验研发楼) 备案号:鄂ICP备2022008796号 网站地图