
瑾萱生物研发生产的基孔肯雅热抗原 Chikungunya virus (CHIKV) E2 / (strain SL-CK1) E2 / Envelope 2 Protein(GX00800)现已上市,全面助力基孔肯雅病毒疫苗研发、抗病毒药物开发和诊断试剂开发。
深入了解基孔肯雅热(Chikungunya Fever)
CHIKV属于披膜病毒科甲病毒属的Semliki forest(SF)抗原复合群。病毒直径约70nm,有包膜,含有3个结构蛋白(衣壳蛋白C、包膜蛋白E1和E2)和4个非结构蛋白(nsP1、nsP2、nsP3和nsP4)。CHIKV的基因组为不分节段的正链RNA,长度约为11~12 kb。病毒基因组编码顺序为5’-NS1-NS2-NS3-NS4-C-E3-E2-E1-3’。通过病毒部分E1基因的系统发生分析可将CHIKV分为3个组:第1组包含了全部西非的分离株,第2组是亚洲分离株,东、中、南部非洲的分离株构成了第3组。它们分别是:东/中/南非谱系(ECSA)、西非谱系(WA)和亚洲谱系(Asian)。
ECSA谱系遗传多样性高,但目前尚未发现CHIKV在人体内适应性增强的氨基酸替换,仅有影响病毒在蚊媒中传播适应性的突变。如E1蛋白第226位氨基酸由丙氨酸突变为缬氨酸(E1-A226V),使病毒在白纹伊蚊中的感染适应性提高约40倍。ECSA谱系中的其它突变,如E2-K252Q、E2-K233E和E2-L210Q,可使白纹伊蚊传播适应性提高5至8倍。在印度发现的E1-K211E和E2-V264A替换对埃及伊蚊传播适应性有轻微增强。
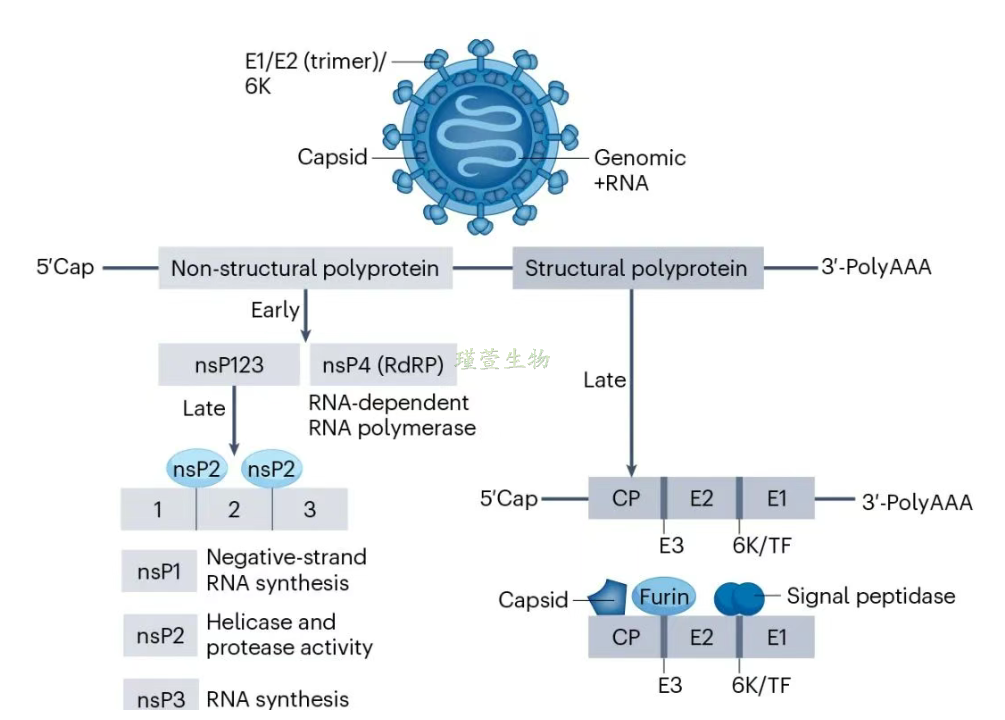
CHIKV病毒结构
(源自文献:doi: 10.1038/s41579-025-01177-8)
1952年首次在坦桑尼亚发现基孔肯雅热疫情。1956年,在泰国首次出现基孔肯雅热城市疫情。1965年,印度发生基孔肯雅热大流行,30万人感染。2013年ECSA谱系病毒传入美洲。2008年3月,我国首次发现基孔肯雅热输入性病例。根据WHO统计,截止2024年12月,全球共有119个国家和地区有基孔肯雅热疫情报道,每年报告病例超50万例,在热带和亚热带地区呈地方性流行。
CHIKV可在Vero、C6/36、BHK-21和HeLa等细胞中繁殖并产生细胞病变。对血细胞如原代淋巴细胞、T淋巴细胞、B淋巴细胞及单核细胞等不敏感。CHIKV可感染非人灵长类、乳鼠等动物。
CHIKV对理化因素的抵抗力较弱,对酸、热、脂溶剂、去污剂、漂白粉、酚、70%酒精和甲醛敏感。
致病机制与临床特征
蚊子叮咬将CHIKV病毒送入人体后,先在皮肤成纤维细胞和肌肉前体细胞中复制,随后经循环系统扩散至关节滑膜、骨骼肌和淋巴组织等靶器官,形成全身性病毒血症。病毒感染诱导机体炎症因子表达升高,引发急性感染。同时,病毒在靶细胞复制、增殖,进一步加剧炎症反应。
基孔肯雅热患者常见的临床表现有:
1,发热:急起发热,患者体温可在短时间内达到39℃以上,一般发热1-7天。部分患者退热后可能会再次出现发热。还会伴有寒战、头痛、背痛、恶心、呕吐等症状。
2,关节疼痛:主要累及手腕、踝趾等小关节,也可能涉及膝肩关节。腕关节受压引起剧烈疼痛是重要特征。急性期多个关节疼痛或关节炎,有肿胀或僵硬,通常1-3周缓解。
3,皮疹:发病2-5天后,50%患者会在躯干、四肢、手掌、足底出现红色斑丘疹或紫癜,部分伴有瘙痒感。数天后消退。
病毒受体与宿主因子
CHIKV感染细胞需要黏附因子与细胞受体协同作用。病毒受体位于宿主细胞表面,特异性结合病毒粒子,介导其内化并引发感染。MXRA8是多种甲病毒的主要受体,如CHIKV、MAYV、RRV、ONNV和SFV。MXRA8能够分别与病毒的E2和E1蛋白相互作用。体内和体外实验发现,阻断或敲除MXRA8均可显著降低病毒感染水平。其他潜在受体CD147和PHB1还需进一步研究。硫酸乙酰肝素和磷脂酰丝氨酸受体蛋白也被发现可增强CHIKV的附着与感染能力。
此外,还有一些宿主因子有助于病毒入侵或复制。FHL1A是CHIKV复制及致病所必需的宿主因子,主要表达于横纹肌和成纤维细胞的细胞质中,与nsP3的高变区发生相互作用。DHX9通过调控CHIKV RNA合成,参与非结构蛋白的翻译过程。CHIKV基因组的高效复制还依赖于人类和蚊虫细胞中的氯离子通道。
病毒感染周期
CHIKV表面的E2–E1刺突蛋白与宿主细胞受体MXRA8及附着辅助因子的结合。结合后通过吞作用进入细胞,并在内体中发生膜融合,在细胞质中解体释放病毒基因组RNA。先生成在病毒复制及逃逸宿主防御机制中起关键作用的nsP1至nsP4等多种非结构蛋白,共同组成病毒复制复合体,负责合成负链RNA中间体。亚基因组mRNA翻译生成结构蛋白,水解丝氨酸蛋白酶将结构蛋白释放至细胞质中。随后,pE2和E1进一步被宿主信号肽酶切割。pE2与E1在高尔基体中形成二聚体,并转运至质膜。在此过程中,pE2被切割为E2和E3。最终,由衣壳蛋白与病毒基因组RNA在细胞质中组装形成病毒核衣壳,会与嵌入质膜的E2/E1二聚体中的E2胞质结构域结合,触发病毒出芽,从而形成成熟的病毒颗粒。
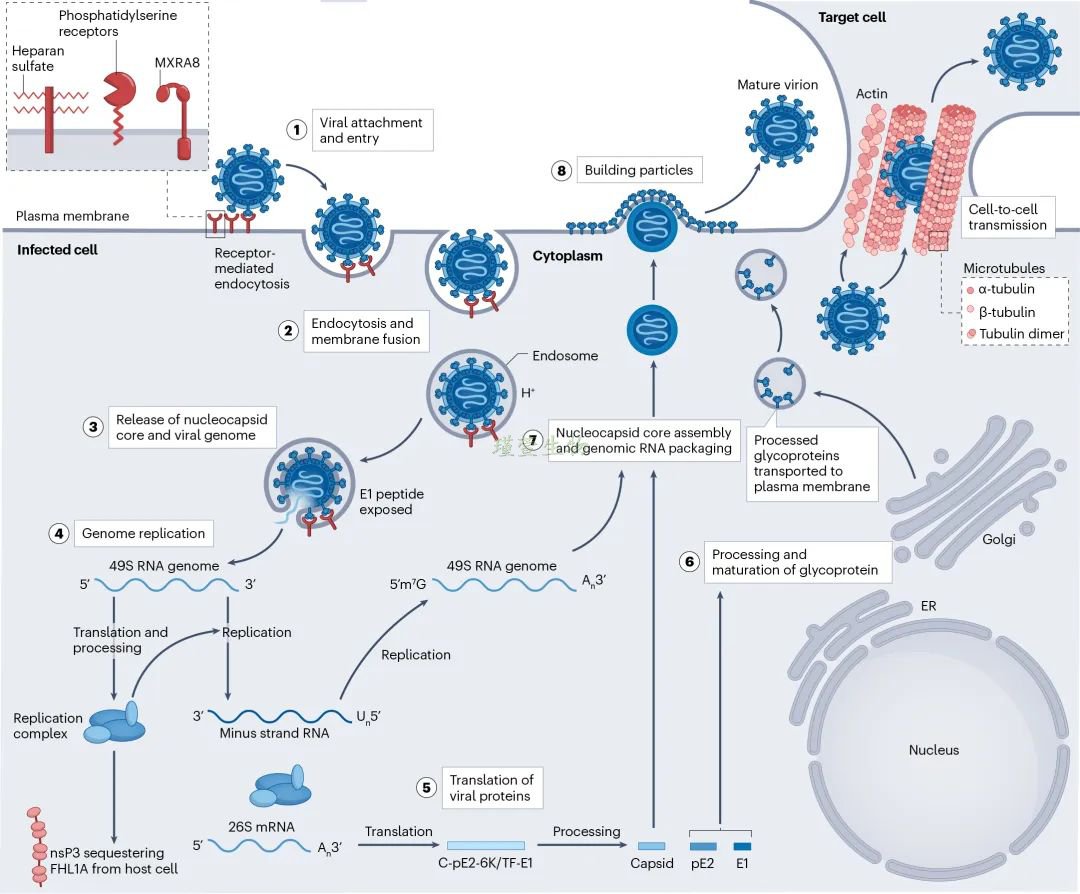
CHIKV病毒入侵机制
(源自文献:doi: 10.1038/s41579-025-01177-8)
临床与动物模型研究均证实,CHIKV可感染滑膜关节中的巨噬细胞和成纤维细胞,导致组织损伤,并诱导大量促炎细胞因子的释放,包括IFNα、IFNβ、IL-8、IL-6及CCL2。在系统性感染清除后,病毒RNA和抗原可能长期残留于关节部位的巨噬细胞、成纤维细胞及肌纤维中,是促成慢性炎症的重要因素。IL-6与基孔肯雅热的严重程度及慢性阶段密切相关。
CHIKV预防与检测
全球已有两款基孔肯雅病毒疫苗获批上市,分别为Ixchiq和Vimkunya。更多的CHIKV候选疫苗处于临床前或临床试验阶段,比如mRNA疫苗、病毒载体疫苗。
Ixchiq是一种减病毒活疫苗,在nsP3蛋白的超变区缺失了60个氨基酸,在复制效率上显著低于野生型CHIKV。Ixchiq于2023年11月获得美国FDA加速批准,安全性与其他减毒活疫苗相当,免疫原性良好,中和抗体水平可稳定维持至少12个月。
Vimkunya是一种病毒样颗粒重组疫苗。病毒样颗粒由衣壳蛋白、E1和E2蛋白组成,来源于西非CHIKV 37997株。病毒样颗粒能够模拟真实的病毒结构,但缺乏病毒基因组RNA,不具备复制能力。Vimkunya于2025年2月获得美国FDA批准,具有良好的耐受性,并可诱导持续长达两年的强效抗体反应。
研究发现,单克隆抗体(mAbs)在预防和治疗CHIKV病毒感染方面具有潜力。mAbs主要通过中和病毒在附着、进入和融合阶段的活性,或抑制病毒与其受体MXRA8的结合来发挥作用。其中,针对E1和E2糖蛋白的中和表位主要集中在A域和B域。mAbs表现出良好的应用前景,但尚处于临床前筛选发现阶段。
根据《基孔肯雅热诊断和治疗方案(2018)》,基孔肯雅病毒检测方法包括核酸检测、病毒分离、血清学检查等。其中血清学检查,可采用ELISA、IFA、免疫层析等方法检测血清特异性IgM或IgG抗体。
目前我国尚无疫苗可供预防基孔肯雅热。CHIKV主要以“人-蚊-人”的方式传播,人感染病毒后2-5天可产生高滴度的病毒血症,被病媒蚊叮咬后,病媒蚊便可能受到感染,若再叮咬其他人,便有机会将病毒传播。因此,控制CHIKV传播的主要方法是控蚊防蚊,预防蚊叮。
Copyright © 2022-2030 武汉瑾萱生物科技有限公司 版权所有 地址:武汉东湖新技术开发区光谷三路777号自贸生物创新港B区(生物医药平台检验研发楼) 备案号:鄂ICP备2022008796号 网站地图