今天给大家介绍的是组氨酸标签(His Tag)
大家可能会有疑问,为什么重组蛋白要使用不同的标签?
因为不同的标签蛋白可以提高重组蛋白的溶解度,并可用于重组蛋白的亲和纯化,因此常用于重组蛋白的表达。在重组蛋白的质粒构建过程中,可以根据需求在目的蛋白的N端或C端添加标签。这些标签的大小范围从几个氨基酸残基到全长蛋白质或结构域,可用于重组蛋白质的纯化、提高稳定性、促进分泌、改善重组蛋白质的产率等。其中常用的重组蛋白常用的标签大致可分为纯化标签和溶解度标签两类。前者与亲和层析结合一起使用,可以快速有效地纯化蛋白质,而后者是指可以促进强蛋白质适当折叠和增强溶解性的标签。
Table1. 常见的亲和标签
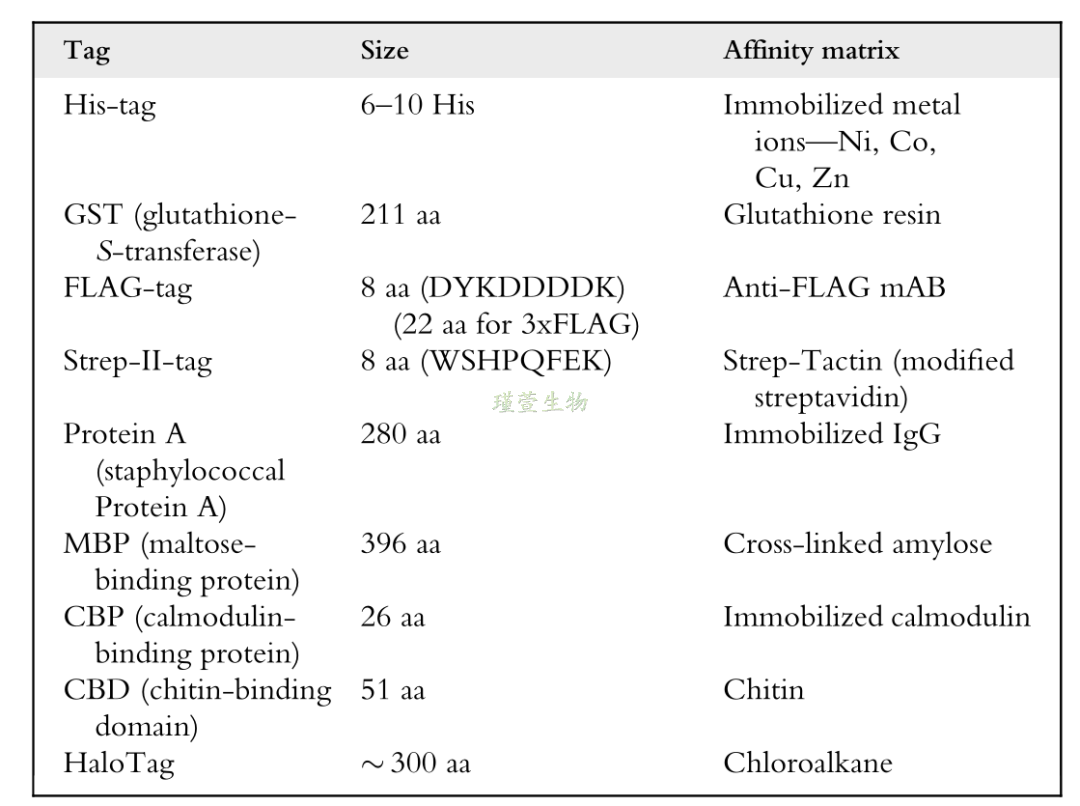
Table2. 常见的溶解度标签

一、组氨酸标签作为常用的纯化标签具体指的是什么,具有什么特点?
组氨酸标签也称His-tag,是一种最简单、应用最广泛的纯化标签,具有六个或更多连续的组氨酸残基,其可插入目的蛋白的C末端或N末端。一是能构成表位利于检测;二是构成独特的结构特征(结合配体)利于纯化。组氨酸标签的特点可总结为以下几点:
1.His标签分子量小,只有~0.84KD,通常不影响重组蛋白质的结构和功能;
2.His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行抗体制备;
3.His标签可以和Ni2+、Co2+等过渡金属离子形成配位键从而与金属离子选择性的结合,而后可以固定在珠子或树脂上进行纯化,目前市面上用于亲和层析的Ni填料也非常普遍;
5.可适用于多种表达系统,纯化的条件温和
6.His标签不需要特定的蛋白质构象进行金属结合,反而在变性条件下,随着his标签变得更加暴露,更有利于纯化,再加上Ni柱对于8M脲素溶液的耐受,同样适用于纯化包涵体蛋白。使用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;
7.His标签融合蛋白也可用于蛋白质相互作用以及蛋白质-DNA相互作用的研究;
二、组氨酸标签的去除
前面提到标签蛋白可以放置在靶蛋白的N端或C端。其中将标签放置在N末端的一个优点是该结构可以利用标签上有效的翻译起始位点。在N端放置标记的另一个优点是,由于大多数内蛋白酶在识别位点的C端或附近切割标记,可以更干净地去除标签蛋白。
如下图所示:组氨酸重组蛋白构建的时将His标签放在目的蛋白的N端,后跟相应的蛋白酶酶切位点,其N-C端的结构为:His-蛋白酶酶切位点-目的蛋白。通过His标签在柱上富集重组目的蛋白,再采用相应的蛋白酶进行酶切,目的蛋白由于失去His标签从柱上洗脱下来,从而实现重组蛋白和His标签的分离。
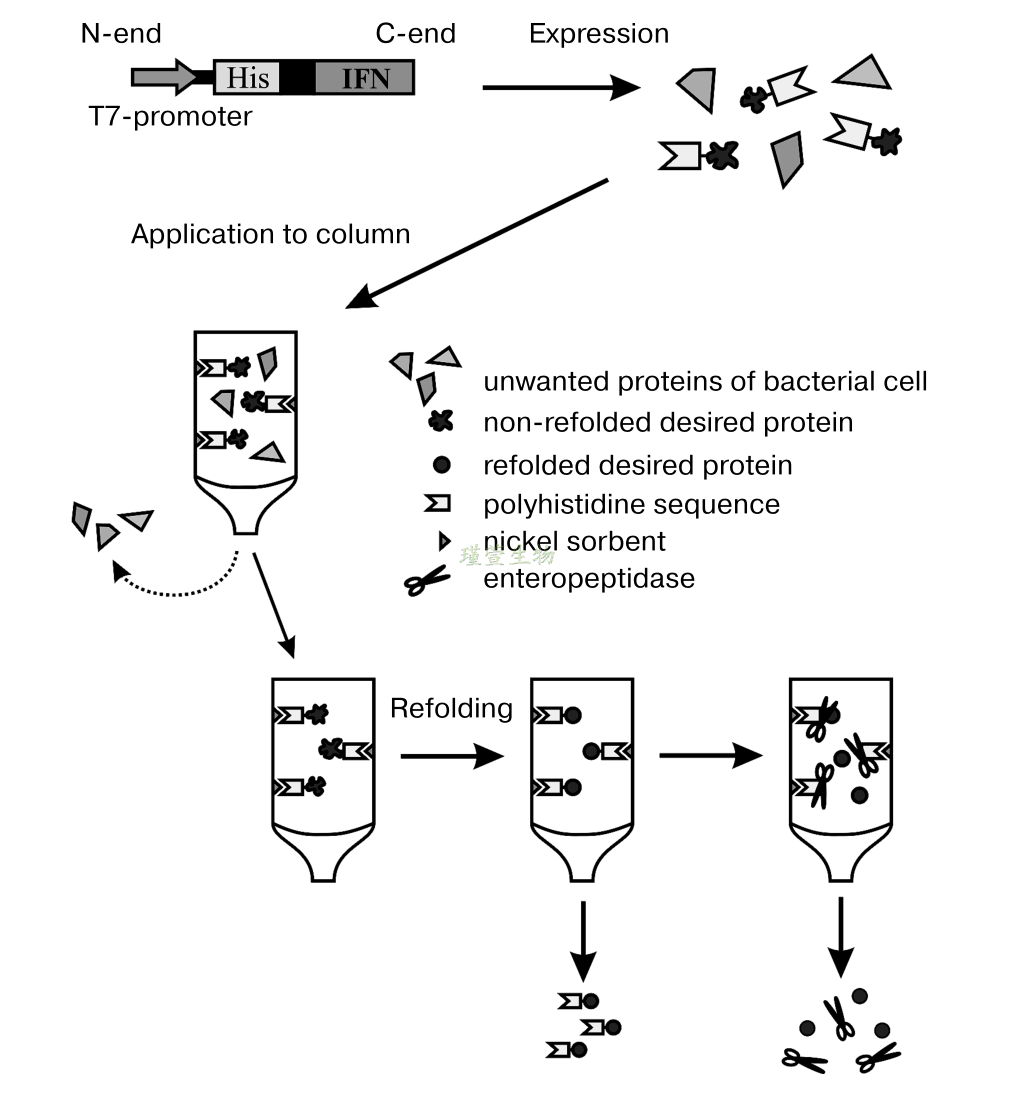
Fig1. 组氨酸标签融合蛋白纯化以及去除标签的流程
三、组氨酸标签的重组蛋白Ni柱纯化步骤
Ni柱亲和层析纯化的原理为咪唑竞争性洗脱,先用低浓度(10-60 mM)的咪唑将杂蛋白和结合不牢的蛋白洗掉,再用合适浓度的咪唑(100-500mM)将目的蛋白洗脱。洗脱的先后顺序与蛋白的结合能力相关。可根据不同的实验目的选择不同的缓冲溶液,常用的包括Tris、磷酸盐溶液等,接下来以Tris缓冲体系为例进行具体的表述。
3.1 溶液配制
Ni柱平衡缓冲溶液:25 mmol/L Tris、10-30 mmol/L咪唑、500 mmol/L NaCl,pH 7.5(缓冲溶液的pH需要根据重组目的蛋白的等电点进行调整,一般和蛋白质的等电点相差2)
Ni柱纯化洗杂溶液:25 mmol/L Tris、30-60 mmol/L咪唑、500 mmol/L NaCl,pH 7.5
Ni柱纯化梯度洗脱溶液:25 mmol/L Tris、100-500 mmol/L咪唑、500 mmol/L NaCl,pH 7.5(配制不同咪唑浓度的溶液,进行梯度洗脱,摸索重组蛋白的最佳纯化条件)
3.2 组氨酸标签重组蛋白的纯化
装柱:
(1) 预处理:市售的Ni Sepharose FF在20%的乙醇溶液中预溶胀。倒去上层20%乙醇溶液,加水至含25%蒸馏水。
(2) 将柱内及柱子底端用水润湿并保持一小段液位(液面略高于滤膜),务必使底端无气泡。
(3) 用玻璃棒引导匀浆沿着柱内壁一次性倒入柱内,注意勿使产生气泡。打开柱子出液口,使介质在柱内自由沉降,连结好柱子顶端柱头。
(4) 打开蠕动泵,让缓冲液用使用时流速的1-3倍的流速流过,使柱床稳定。
平衡:用5-10倍柱体积的Ni柱平衡缓冲溶液(25 mmol/L Tris、10-30 mmol/L咪唑、500 mmol/L NaCl,pH 7.5)平衡柱子。
上样:0.45μm过滤后的含有重组目的蛋白的上清液流过Ni柱(流速1 mL/min),收集流穿液。
洗杂:用5-10倍柱体积的Ni柱纯化洗杂溶液洗去层析柱中未结合杂蛋白。
洗脱:用不同咪唑浓度的Ni柱纯化梯度洗脱溶液缓冲液目的蛋白
清洗和保存:用含有500 mM咪唑的洗脱液充分冲洗Ni柱后(大于10个柱体积),将Ni柱充分用蒸馏水冲洗(大于30个柱体积),置换到20%的乙醇溶液中4℃冰箱保存。
得到的蛋白洗脱液采用SDS-PAGE分析纯化情况。收集含有目的蛋白的洗脱液进行后续实验
Copyright © 2022-2030 武汉瑾萱生物科技有限公司 版权所有 地址:武汉东湖新技术开发区光谷三路777号自贸生物创新港B区(生物医药平台检验研发楼) 备案号:鄂ICP备2022008796号 网站地图